پاتوژن ها در آب
پاتوژن ها در آب:
پاتوژن ها (میکروب های بیماری زا) پس از ورود به بدن میزبان، با تهاجم و تکثیر در بافت های بدن، ممکن است به بیماری میزبان منجر شوند. از نظر بهداشتی، حضور پاتوژن ها در آب آشامیدنی موجب نگرانی انسان است. هر بیماری که پاتوژن عاملِ آن، از طریق آب آلوده وارد بدن شود را بیماری آب زاد می نامند. وقتی شبکه آب آشامیدنی شهری به پاتوژنی آلوده شود، ممکن است تعداد زیادی از سکنه شهر را به طور هم زمان مبتلا به بیماری کند. برای مثال، در سال 1993 میلادی در شهر میلواکی آمریکا، بیش از 400000 نفر به خاطر مصرف آب آشامیدنی آلوده به گونه های سرده Cryptosporidium به عفونت روده ای مبتلا شدند.
پاتوژن های آب، جزء گروه میکروب های دگرجازاد به شمار می روند؛ زیرا در دستگاه گوارش انسان و حیوانات خون گرم فراوان اند و معمولاً از طریق فاضلاب ها وارد آب می شوند وبا، حصبه، اسهال و اسهال خونی (دیسانتری) از بیماری های آب زاد متداولی اند که هنوز گاهی در کشورهای کمتر توسعه یافته، از طریق آب آشامیدنی آلوده، وقوع آنها همه گیر می شود. علاوه بر باکتری عامل وبا (Vibrio cholera) و باکتری عامل حصبه (Salmonella enterica)، اخیراً در آب های آلوده، پاتوژن های باکتریایی جدیدی، مثل گونه های پاتوژنی Escherichia coli، Campylobacter jejuni و Yersinia pestis، شناسایی شده اند.
برخی از تک یاختگان نیز جزء پاتوژن های آب هستند که عمدتاً موجب عفونت های رودهای و ناراحتی های گوارشی می شوند؛ برای مثال میتوان از تک یاختگان Entamoeba histolytica، Giardia lambias، Cryptosporidium parvum و Balantidium coli نام برد.
انگل، موجودی است که به طور اجباری یا اختیاری در درون یا بر سطح موجود زنده دیگری زندگی می کند و برای ادامه زندگی به میزبان نیاز دارد. انگل های آب، به طرق مختلف، همچون آشامیدن آب آلوده، خوردن سبزی های آلوده، تماس بدن با آب های کشاورزی و تماس بدن با لجن و خاک آلوده، به انسان منتقل می شوند. هرچند تقریباً بیماری های آب زادِ انگلی در کشورهای توسعه یافته مشاهده نمی شوند، ولی هنوز در بسیاری از کشورهای توسعه نیافته وجود دارند. برای نمونه می توان از بیماری های آمکاریوزیس (با انگل عامل Ascaris lumbricoides) و شیستوزومازیس (با انگل عامل Sckistosoma) نام برد، که موجب عفونت های داخلی می شوند.
ویروس ها از ساختار ساده تری نسبت به دیگر موجودات زنده برخوردارند و همه آنها دارای زندگی انگلی بوده و برای حیات به میزبان نیاز دارند. ویروس ها در خارج از بدن میزبان دارای فعالیت متابولیسمی نیستند، ولی می توانند برای مدتی زنده بمانند. از ویروس های متداول موجود در فاضلاب، قادر به تولید عفونت داخلی، می توان از گونه های Enteroviruse، calicivirus، Rotavirus، Adenovirus، hepatitis A virus و hepatitis E virus نام برد. هپاتیت از بیماری های آب زادِ شناخته شده ای است که عوامل آن ویروس های هپاتیت هستند.
نشانگرهای آلودگی میکروبی آب:
چون تعداد پاتوژن ها در آب، معمولاً کم است؛ جداسازی و شناسایی آنها مشکل است. بنابراین، به جای آزمایش پاتوژن ها، میکروب های نشانگر برای تعیین آلودگی میکروبی آب انتخاب و مورد آزمایش قرار می گیرند. هر نشانگر ایده آل باید مشخصات زیر را داشته باشد.
- نشانگر باید در آبِ آلوده به مدفوع حضور داشته باشد؛
- از نظر تعداد، نشانگر باید بسیار فراوان تر از پاتوژن ها باشد؛
- نشانگر باید در محیطِ خارج از بدن میزبان، طولانی تر از پاتوژن زنده بماند؛
- نشانگر نباید در خارج از بدن میزبان، تولید مثل کند؛
- جداسازی و شناسایی نشانگر باید سریع تر، آسان تر و ارزان تر از پاتوژن باشد؛
- نشانگر، عضوی از میکروب های دستگاه گوارش انسان و حیوانات خون گرم باشد.
1- نشانگرهای باکتریایی
دستگاه گوارش انسان و حیوانات خون گرم حاوی جمعیت زیادی از باکتری هایی است که صفات زیست شیمیایی و ریخت شناسی یکسانی دارند، و به مجموعه آنها باکتری های کُلیفرم گفته می شود. باکتری های کُلیفرم نوعاً هوازی و بی هوازی دو گونه زی، گرم – منفی، میله ای شکل و فاقد قدرت تشکیل هاگ (اسپور) هستند که قادرند لاکتوز را در مدت 48 ساعت در دمای ℃ 35 تخمیر و اسید و گاز تولید کنند. باکتری های کُلیفرم در مدفوع انسان و حیوانات خون گرم بسیار فراوان اند؛ به طوری که هر نفر در شبانه روز بین 100 تا 400 میلیارد باکتری کُلیفرم دفع می کند. باکتری های کُلیفرم، به عنوان نشانگر آلودگی میکروبی آب، مدت طولانی است که موردِ استفاده قرار گرفته اند؛ به طوری که حضور آنها در آب، نشانگر تماس احتمالی آب با مدفوع و احتمال حضور پاتوژن ها در آن قلمداد میشود.
باکتری های کُلیفرم ممکن است منشأ مدفوعی نداشته باشند، زیرا در محیطهای آبی و خاکی و حتی روی سطح گیاهان هم حضور دارند؛ در نتیجه، در آب، علاوه بر تعیین کل باکتریهای کُلیفرم، به نشانگرهای تکمیلی نیاز است که فقط منشأ مدفوعی داشته باشند. آزمایش کُلیفرم مدفوعی (FC)، آن بخش از باکتری های کُلیفرم را مشخص میکند که گرمادوست و عمدتاً ساکن دستگاه گوارش انسان و حیوانات خونگرماند. در این آزمایش، دمای انکوباسیون ℃ 0/5 ± 44 انتخاب میشود؛ زیرا در این دما، بجز باکتریهای کُلیفرم گرمادوست، بقیه باکتری ها از بین می روند و یا قادر به متابولیسم نیستند. اشکال این آزمایش آن است که ممکن است برخی از گونه های کُلیفرمِ گرمادوست با منشأ غیرمدفوعی (مثل گونه های سرده Klebsiella و Citrobacter) در نمونه حضور داشته باشند. بنابراین، حضور کُلیفرم های مدفوعی در آب، ضرورتاً نشانگر تماس آب با مدفوع نیست.
در سال 1885 میلادی، محقق آلمانی به نام اشریشیا، باکتری اشریشیاکُلی (E. coli) را از گروه کُلیفرم ها یافت که به تعداد زیادی در مدفوع انسان و حیوانات خونگرم وجود دارد (حدود یک میلیارد در هر گرم مدفوع و حدود 11 درصد کل کلیفرم های موجود در مدفوع). بنابراین، E. coli به دلیل فراوانی در مدفوع و داشتن منشأ مدفوعی، نشانگر مناسبی برای تعیین آلودگی مدفوعی آب است. اکثر گونه های E. coli برای انسان بی ضررند، ولی گونه های پاتوژنی نیز دارند. در آزمایش E. coli، از محیط کشت ویژة حاوی ام یو جی (MUG) استفاده می شود. E. coli با آنزیم خاص جی یو اس بی (GUSB)، در دمای انکوباسیون ℃ 0/5 ± 44 ، قادر به شکستن MUG و آزاد کردن رنگ آبی براق است، که این ویژگی باعث شناسایی آن میشود. اشکال این آزمایش آن است که ممکن است برخی از گونه های E. coli در محیط های طبیعی بعضی از مناطق گرمسیری رشد کنند. بنابراین در این مناطق، ممکن است حضور E. coli در آب نشانگر قطعی تماس آب با فاضلاب نباشد.
استرپتو کوکسی مدفوعی (FS)، گروه دیگری از باکتری های ساکن در دستگاه گوارش انسان و حیوانات خون گرم اند که در بین آنها گونه های پاتوژنی هم وجود دارد. مشاهده شده است که نسبت کُلیفرم مدفوعی (FC) به استرپتو کوکسی مدفوعی، یعنی FC/FS، برای انسان بیش از 0/4 و برای دام کمتر از 0/1 است. بنابراین در جایی که تعیین منشأ انسانی و حیوانی آلودگی آب مورد نظر باشد، انجام آزمایش استرپتوکوکسی مدفوعی، علاوه بر آزمایش کُلیفرم مدفوعی و تعیین نسبت آنها راهگشا خواهد بود.
استانداردهای آب آشامیدنی، تعداد کُلیفرم های مدفوعی را در تمام شرایط، صفر تعیین کرده اند؛ ولیکن در شرایط خاصی که امکان دسترسی به آب تصفیه شده وجود نداشته باشد، حداکثر کل کُلیفرم 10 عدد در mL100 آب؛ در بعضی از نمونه ها و به شرطی که کُلیفرم های مدفوعی نداشته باشند، را مجاز دانسته اند.
2- نشانگرهای ویروسی
باید توجه کرد که آزمایش های کل کُلیفرم، کلیفرم مدفوعی و E. coli نمیتوانند مؤید حضور یا عدم حضور پاتوژن های ویروسی در آب باشند، برای مثال، مشاهده شده است که گاهی ویروس ها قادرند در محیط خارج از میزبان، طولانیتر از باکتری های کُلیفرم زنده بمانند؛ یا مشاهده شده است که دو پرتوزوان آب زاد Giardia lamblia و Cryptosporidium parvum قادرند با تشکیل یک کیسة محافظ، به مدت طولانی در محیط زیست زنده بمانند و در مقابل گندزداهای شیمیایی، مثل کلر، مقاوم تر از کُلیفرم ها باشند.
امروزه، به عنوان نشانگر تکمیلی آلودگی میکروبی آب، توجه به باکتریوفاژها (ویروسهای عفونت زا در باکتری ها) معطوف شده است. باکتریوفاژهایی که E. coli را عفونی کنند، به کُلی فاژ موسوم اند. کُلی فاژهایی که فقط گونه های مذکر E. coli را عفونی کنند، موسوم به کُلی فاژهای ویژه نر، فقط در مدفوع یافت می شوند. در بین کُلی فاژهای ویژه نر، بعضی از سروتیپ های آن فقط در مدفوع انسان و برخی نیز فقط در مدفوع حیوانات حضور دارند. در حالی که غیاب کُلیفرم ها مؤید عملکرد خوب سامانه تصفیه در حذف باکتری هاست، غیاب کُلی فاژها نیز مؤید بازدهی خوب سامانه تصفیه در حذف ویروس ها قلمداد می شود.
شناسایی و تعیین فراوانی باکتری های کُلیفرم:
دو روش استاندارد و متداول برای شناسایی و تعیین فراوانی باکتری های کُلیفرم، به روش صافی غشایی و روش تخمیر چندلولهای هستند.
1- روش صافی غشایی
در آزمایش صافی غشایی، حجم مشخصی از نمونه آب از یک صافی غشایی (معمولاً با اندازه منافذ ) عبور داده میشود تا باکتری ها روی صافی بمانند. سپس صافی را در بشقابک آزمایشگاهی حاوی محیط کشت مناسب برای رشد باکتری های کُلیفرم قرار داده، آن را به مدت 24 ساعت در انکوباتور در دمای ℃ 0/5 ± 35 نگه داشته، تا کلنی های میکروبی تشکیل و شمارش شوند.
در آزمایش صافی غشایی، حجم نمونه ای که صاف می شود، به فراوانی باکتری های موجود در نمونه بستگی دارد. معمولاً برای آب آشامیدنی از mL100 نمونه، ولی برای آب های آلوده تر و کدتر از حجم کمتری استفاده می شود، به طوری که بیش از 50 کلنی کلیفرم در هر بشقابک آزمایشگاهی تشکیل شود. در این آزمایش، فراوانی کُلیفرم ها برحسب یکای کُلنی ساز (CFU) بر حجم (معمولاً mL100 /CFU) گزارش می شود. علت به کار بردن CFU به جای تعداد کُلیفرم ها، عدم قطعیت از تشکیل هر کُلنی توسط فقط یک باکتری زنده است؛ زیرا ممکن است هر کلنی از چند باکتری زنده تشکیل شده باشد. پس از شمارش تعداد کلنی های تشکیل شدة مجزا، فراوانی کُلیفرم های نمونة آب از رابطة زیر به دست می آید:

که در آن، s∀ حجم آب صافشده (mL) است.
2- روش تخمیر چندلوله ای
در آزمایش تخمیر چندلوله ای، از ویژگی کُلیفرم ها در تخمیر لاکتوز و تولید گاز استفاده می شود. در این آزمایش، نمونه به لوله آزمایش حاوی محیط کشت لاکتوزدار منتقل و سپس به مدت h3 ± 48 در دمای ℃ 0/5 ± 35 در انکوباتور نگهداری می شود. پس از انکوباسیون، وجود گز در لوله آزمایش، معرف وجود باکتری های کُلیفرم در آن است.
در این آزمایش، معمولاً چند مرحله رقیق سازی متوالی، با ضریب توالی 10، انجام می گیرد، برای مثال، اگر حجم های 10، 1 و mL 0.1 از نمونه اصلی را با آب مقطر به حجم mL100 برسانیم، سه نمونه رقیق شده متوالی از نمونه اصلی با ضرایب رقیق سازی 10، 100 و 1000 به دست می آید؛ به طوری که، ضریب رقیق سازی در nاُمین مرحله است. در عمل، معمولاً سه نمونه رقیق شده و پنج تکرار از هر نمونه (جمعاً 15 لوله آزمایش) استفاده می شود. لوله های آزمایش، هم زمان، به مدت h3 ± 48 در دمای ℃ 0/5 ± 35 در انکوباتور نگهداری می شوند، تا پس از انکوباسیون، لوله های مثبت (گازدار) مشخص شوند. هر چه تعداد نمونه های رقیق شده و نیز تعداد تکرار از هر نمونه بیشتر باشد، فراوانی کُلیفرم ها با نتیجة دقیق تری به دست می آید. آزمایش تخمیر چندلوله ای در سه مرحله: احتمالی، تأییدی و تکمیلی صورت می گیرد. با این آزمایش علاوه بر تعیین فراوانی کل کُلیفرم ها، می توان فراوانی گونه های خاص کُلیفرم، همچون کُلیفرم مدفوعی و E. coli، را نیز مشخص کرد.
در روش تخمیر چندلوله ای، فراوانی کُلیفرم ها، بر اساس نظریة احتمالات، معمولاً به صورت محتمل ترین تعداد در mL100 (mL100/ MPN) گزارش می شود. در واقع، MPN معرف تعداد دقیق کُلیفرم ها در نمونه نیست، بلکه برآورد آماری از بیشترین احتمال تعداد آنها و برمبنای احتمال توزیع پواسون استوار است. برای سه مرحله رقیق سازی و پنج تکرار، احتمال وقوع یک نتیجة خاص، برمبنای توزیع پواسون، از رابطه زیر به دست می آید:

که در آن، y احتمال وقوع یک نتیجة خاص، aثابت، ∀ حجم نمونه در هر لوله آزمایش در هر مرحله رقیق سازی (mL)، Nفراوانی کُلیفرم ها در واحد حجم، pتعداد لوله های مثبت (گازدار) و qتعداد لوله های منفی (بدون گاز) در هر مرحله رقیق سازی است. در این رابطه، آن مقدار از Nکه بیشترین مقدار ya را نتیجه دهد، معرف MPNدر واحد حجم خواهد بود. برای گزارش فراوانی کُلیفرم ها برحسب mL100/ MPN، باید نتیجه به دست آمده از معادله 9- 6 را در عدد 100 ضرب کرد.
از پیوست 1، جدول پ – 6، مقادیر mL100/ MPN به دست آمده از توزیع پواسون، معادله 9- 6، برای سری حجم های ∀1= 10 mL ، ∀2= 1 mL و ∀3= 0/1 mL و هر کدام با پنج بار تکرار، ارائه شده اند. اگر نمونه های آزمایش شده، رقیق تر از نمونه های جدول پ- 6 باشند، باید مقدار قرائت شده از این جدول را در ضریب تصحیح رقیق سازی ضرب کرد، که این ضریب برابر است با حاصل تقسیم حجم نمونه در جدول بر حجم نمونه آزمایش شده؛ برای مثال، اگر در آزمایش از سری حجم های 100، 10 و 1 میلی لیتر استفاده شده باشد، باید مقدار قرائت شده از جدول را با اعمال ضریب 1/0 = 100/10 اصلاح کرد؛ به طور مشابه، اگر از سری حجم های 1، 1/0 و 01/0 میلی لیتر استفاده شده باشد، باید مقدار قرائت شده از جدول را با اعمال ضریب 10 = 1/10 اصلاح کرد. اگر بیش از سه نمونه رقیق شده استفاده شود، برای استفاده از جدول پ- 6، باید از نتایج سه نمونه رقیق شدة متوالی استفاده کرد؛ در این راستا، بهتر است از نتایج نمونه ای شروع کرد که اگر لوله های آن مثبت بودند، تمام لوله های نمونة بعدی مثبت نباشند. در ضمن، اگر در بین لوله های نمونه هایی که بیشتر رقیق شده اند (یعنی چهارمین و پنجمین مرحله رقیق سازی) هنوز لوله مثبت وجود داشته باشد، باید تعداد لوله های مثبت آن به تعداد لوله های مثبت سومین مرحله رقیق سازی (تا سقف 5) افزوده شود.
از رابطه زیر، موسوم به معادله توماس، نیز می توان فراوانی کُلیفرم ها را با تقریب قابل قبول به دست آورد:
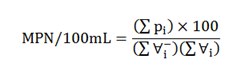
که در آن، ∑pi تعداد لوله های مثبت در تمام نمونه ها، ∑∀i– مجموع حجم های نمونه ها در کل لوله های منفی (بدون گاز) (mL) و ∑∀i مجموع حجم های نمونه ها در تمام لوله ها (mL) است. در کاربرد رابطه توماس، بهتر است که از نتایج اولین نمونه که تمام لوله های آن مثبت باشد، صرف نظر کرد.










