نیتروژن آلی در آب
نیتروژن آلی در آب (Organic nitrogen)
از نظر شیمی تجزیه، نیتروژن آلی به نیتروژن مقید در مواد آلی با حالت اکسایش 3- گفته می شود؛ به طوری که بتوان آن را با روش کِلدال (Kjeldahl method) اندازه گیری کرد. در روش کِلدال، نیتروژن تمام ترکیبات آلی نیتروژن دار اندازه گیری نمی شود؛ بلکه نیتروژن مواد آلی طبیعی همچون پروتئین ها، پپتیدها (peptide)، نوکلوئیک اسیدها و اوره (urea [(NH2)2CO]) و نیز نیتروژن بسیاری از ترکیبات آلی سنتزی اندازه گیری می شود و این روش نمی تواند نیتروژن ترکیبات آلی همچون آزید (azide (N3–))، ترکیبات آزو (azo compounds (R-N=N-R’)، نیتریل، ترکیبات نیترو (nitro compound (R-NO2)) ترکیبات نیتروزو و هیدارزین را اندازه گیری کند. در روش کِلدال، نیتروژن آمونیاکی که دارای حالت اکسایش 3- است نیز همراه با نیتروژن آلی اندازه گیری می شود؛ به طوری که کل نیتروژن کِلدال (TKN)، مجموع نیتروژن آلی و کل نیتروژن آمونیاکی است.

در روش کِلدال، نمونه آب به کمک اسید و حرارت، هضم شده تا نیتروژن آلی آن به آمونیوم تبدیل شود. سپس نیتروژن آمونیاکی تولیدشده اندازه گیری می شود. در صورتی که فقط اندازه گیری نیتروژن آلی آب (بدون نیتروژن آمونیاکی) موردِ نظر باشد، باید قبل از هضم، نمونه را جوشانده تا تمام آمونیاک آن از محلول خارج شود. درضمن، از تفریق مقادیر کل نیتروژن کِلدال و کل نیتروژن آمونیاکی نیز می توان نیتروژن آلی را برآورد کرد.
از روش اکسایش نورشیمیایی نیز می توان به جای روش کِلدال برای اندازه گیری نیتروژن آلی استفاده کرد. در این روش ها، نیتروژن آلی و نیتروژن آمونیاکی به نیترات اکسیده و سپس مقدار آن اندازه گیری می شود. البته قبل از اکسایش نورشیمیایی، باید مقادیر نیتریت و نیترات زمینۀ موجود در نمونه را اندازه گیری کرد. اگر نمونه، قبل از آزمایش کِلدال یا نورشیمیایی از صافی عبور کند، آنگاه نیتروژن آلی محلول (به جای کل نیتروژن آلی) تعیین مقدار می شود.
غلظت های نیتروژن آلی آب های طبیعی از چند میکروگرم بر لیتر در آب بعضی از دریاچه های تمیز تا بیش از mg N/L 20 در فاضلاب خام متغیر است. در استانداردهای آب آشامیدنی، ممولاً حد مجازی برای نیتروژن آلی تعیین نشده است، ولی بعضی از آنها (مثل استاندارد EU) حد مجازی برای کل نیتروژن کِلدال مشخص کرده اند. در استاندارد EU، حداکثر مجاز نیتروژن کِلدال mg N/L 1 مقرر شده است.
نیتروژن کل
چرخه و تبدیلات نیتروژن
چرخه طبیعی نیتروژن از اهمیت زیادی در مدیریت کیفیت منابع آب برخوردار است. در فرایند تثبیت زیستی نیتروژن، نیتروژن جوّ توسط برخی از باکتری ها و سانوباکتری ها به آمونیاک تبدیل می شود. در مواقع طوفانی، آذرخش نیز باعث تثبیت نیتروژن می شود. در کارخانه های کود سازی، نیتروژن جوّ به آمونیاک یا نیترات تبدیل می شود. نیتروژن تثبیت شده، مجدداً به طور زیستی، به گاز تبدیل و به جوّ بازگردانده می شود (سری فرایندهای نیترات سازی و نیترات زدایی). از واپاشی لاشه های گیاهی و حیوانی، نیتروژن آلی به نیتروژن آمونیاکی تبدیل می شود (فرایند کانی سازی یا آمونیاک سازی نیتروژن آلی). آمونیاک طی فرایند نیترات سازی، ابتدا به نیتریت و سپس به نیترات تبدیل می شود. نیترات و آمونیاک جذب گیاه و میکروب ها شده، به نیتروژن آلی تبدیل می شوند (فرایند جذب گیاهی نیتروژن). حیوانات با مصرف گیاهان و میکروب ها، نیتروژن کسب می کنند که در زیست تودۀ حیوانی (به صورت نیتروژن آلی) باقی می ماند یا با فضولات حیوانی دفع می شود. شکل 1 چرخه نیتروژن را نشان می دهد.

تثبیت نیتروژن
فرایند تبدیل گاز نیتروژن جوّ به ترکیبات نیتروژن، همچون آمونیاک، نیترات و نیتریک اسید (NO) را تثبیت نیتروژن می نامند. تثبیت نیتروژن به دو طریق: زیستی و غیر زیستی، صورت می گیرد. در تثبیت زیستی نیتروژن، دیازوتروف ها (diazotrophs (nitrogen fixing bacteria) – باکتری های تثبیت کنندۀ نیتروژن) گاز نیتروژن جو را به آمونیاک تبدیل می کنند. دیازوتروف ها شامل گونه های شیمی پرورد (chemotroph – شیمی تروف) و نیز نورپرورد (phototroph, phototrophic organism – فوتوتروف) هستند. در ضمن، امکان تثبیت بیولوژیکی نیتروژن در هر دو محیط هوازی و بی هوازی وجود دارد.
تثبیت نیتروژن به طریق غیر زیستی در آذرخش، کارخانه کودسازی و احتراق سوخت های فسیلی رخ می دهد. از متداول ترین فرایندهای تثبیت نیتروژن به روش صنعتی، فرایند هابر – بوش (Haber- Bosh process) است که در آن، در دما و فشار خیلی زیاد و در حضور کاتالیزور، نیتروژن جوّ و هیدروژن با هم ترکیب شده و آمونیاک تولید می شود. در نتیجۀ احتراق سوخت های فسیلی، نیتروژن اکسیدها (NOx) تولید می شوند. در مواقع طوفانی، آذرخش باعث می شود که از N2 و O2 جوّ، نیتریک اکسید (NO) و نیترات تولید شود.
جذب گیاهی و حیوانی نیتروژن
گیاهان، آمونیوم یا نیترات موجود در آب را از طریق ریشه جذب و آن را در سنتز پروتئین مصرف می کنند. اگر نیترات جذب گیاه شود، ابتدا باید به نیتریت و سپس به آمونیم کاهش یابد تا در سنتز گیاهی به کار رود. بنابراین، اکثر گونه های گیاهی ترجیح می دهند که آمونیوم جذب کنند تا برای رشد به انرژی کمتر نیاز داشته باشند. جذب گیاهی آمونیوم و نیترات عامل اصلی کنترل غلظت نیتروژن معدنی در آب است.
کانی سازی نیتروژن آلی
باکتری های تجزیه کنندۀ مواد آلی، بخشی از نیتروژن مواد آلی را صرف تولید زیست توده باکتریایی کرده و باقی مانده را به صورت آمونیاک وارد محیط زیست می کنند. فرایند زیستی تبدیل نیتروژن آلی به آمونیاک را کانی سازی یا آمونیاک سازی نیتروژن آلی می نامند. باکتری ها، نوعاً 5 عدد کربن آلی را صرف سنتز زیست توده می کنند. وزن خشک زیست تودۀ باکتریایی حدود 50 درصد کربن و 10 درصد نیتروژن دارد. با توجه به این ارقام نوعی می توان میزان کانی سازی نیتروژن آلی را بر آورد (مثال 1).
مثال 1- آمونیاک سازی نیتروژن آلی
زیست تودۀ گیاهی منبع آبی، حاوی 42 درصد کربن و 4 درصد نیتروژن (بر مبنای جرم خشک) است، برای زیست تخریبی 1000 گرم آن، میزان آمونیاک سارزی چقدر است؟ فرض کنید که 5 درصد کربن زیست تودۀ گیاهی صرف سنتز زیست تودۀ باکتریایی، با محتوای 50 درصد کربن و 10 درصد نیتروژن شود.
حل:
1- محاسبه جرم خشک کربن و نیتروژن در 1000 گرم زیست تودۀ گیاهی:

2- محاسبه جرم کربن مصرف شده در سنتز زیست تودۀ باکتریایی:

3- محاسبه جرم زیست تودۀ سنتز شده:

4- محاسبه جرم نیتروژن مصرف شده در زیست تودۀ جدید:

5- محاسبه جرم نیتروژن آمونیاکی شده:

بنابراین 35/8 گرم نیتروژن از 1000 گرم ماده آلی حاوی 4 درصد نیتروژن وارد آب می شود.
نیترات سازی
نیترات سازی، اکسایش زیستی آمونیاک به نیتریت و سپس به نیترات است که توسط موجودات نیترات ساز، به خصوص باکتری های نیترات ساز، انجام می گیرد. تمام باکتری های نیترات ساز شیمی خودپرورد هوازی اند؛ به طوری که کربن را از کربن دیوکسید و انرژی را از اکسایش آمونیاک یا نیتریت کسب می کنند. در واکنش های متابولیسمی باکتری های نیترات ساز، آمونیاک یا نیتریت به عنوان الکترون دهنده و اکسیژن به عنوان الکترون پذیر عمل می کنند. باکتری های اُکسندۀ آمونیاک (ammonia-oxidizing bacteria (AOB)) عمدتاً مربوط به سرده Nitrosomonas و باکتری های اُکسندۀ نیتریت (NOB) عمدتاً مربوط به سرده Nitrobacter هستند.
عملکرد مرحله نیترات سازی را می توان با واکنش های زیر نشان داد:
واکنش 1:

واکنش 2:
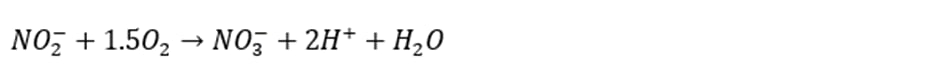
از جمع دو واکنش بالا داریم
واکنش 3:

یون هیدروژن حاصل از واکنش های نیترات سازی، باعث کاهش قلیائیت آب می شود.
مثال نیترات سازی:
برای نیترات سازی g/m3 1 آمونیاک بر حسب N، چقدر اکسیژن لازم است؟ و چقدر قلیائیت کاهش می یابد؟
حل:
1- محاسبه غلظت اکسیژن مورد نیاز: از واکنش 3 ملاحظه می شود که به ازای هر مول آمونیاک که اکسیده شود، به دو مول اکسیژن محلول نیاز است، پس

2- محاسبه قلیائیت خنثی شده: از واکنش 3 ملاحظه می شود که به ازای هر اکیوالان آمونیاک که اکسید شود، دو اکیوالان یون هیدروژن تولید یا دواکیوالان قلیائیت خنثی می شود.

عوامل محیطی تأثیر گذار بر آهنگ نیترات سازی عبارت اند از:
- واکنش های نیترات سازی در شرایط هوازی مطلق رخ می دهند و اگر غلظت اکسیژن محلول کمتر از mg/L 2 شود، آهنگ واکش ها به سرعت کاهش می یابد.
- گسترۀ pH بهینه برای نیترات سازی بین 8 و 9 است. در pH کمتر از 6، واکنش ها متوقف می شوند.
- موجودات نیترات ساز تمایل به سکونت روی ته رسوبات یا سطوح جامد دارند؛ بنابراین، نقطه مطلوب فرایند نیترات سازی در سطح مشترک آب – رسوب است.
- آهنگ رشد موجودات نیترات ساز بسیار کمتر از آهنگ رشد دگرپروردها است؛ در نتیجه، اگر غلظت مواد آلی زیست تجزیه پذیر زیاد باشد، دگرپروردها باعث محدود شدن رشد نیترات سازها شده و نیترات سازی متوقف می شود.
- محدودۀ دمای بهینه برای فرایند نیترات سازی بین 20 و ℃25 است و در خارج از این محدوده از آهنگ آن کاسته می شود.
نیترات زدایی
نیترات زدایی، فرایند زیستی کاهش (احیاء) نیترات است که پس از تولید یک سری ترکیبات نیتروژن میانی (NO2–، NO و N2O)، سرانجام به تولید گاز نیتروژن مولکولی (N2) منجر می شود. در نیترات زدایی، مولکول نیتروژنِ اُکسیده (NO3–، NO2–، NO یا N2O) به عنوان الکترون پذیر (به جای اکسیژن) و مولکول مواد آلی به عنوان الکترون دهنده عمل می کنند. باکتری های نیترات زدا (denitrifying bacteria, denitrifier)، عمدتاً دگرپروردِ بی هوازیِ دو گونه زی اند و فرایند متابولیسمی آنها به متابولیسم کم اکسیژنی (anoxic metabolism) موسوم است. در فرایند کامل تبدیل نیترات به گاز نیتروژن مولکولی، چندین گونه باکتریایی مختلف درگیرند.
نیترات زدایی تحت شرایطی انجام می گیرد که محیط از اکسیژن تهی باشد و نیترات به عنوان الکترون پذیر عمل کند. بنابراین، در طبیعت، نیترات زدایی در محیط های آب که آهنگ مصرف اکسیژن بیش از آهنگ دریافت آن باشد، رخ می دهد؛ مثلاً، در بعضی از خاک ها و آب های زیرزمینی، در تالاب ها، در گوشه های کمتر تهویه پذیر دریاها و در ته رسوبات. آهنگ نیترات زدایی در اکوسیستم های آب که غلظت نیترات و مواد آلی آنها کم است، معمولاً قابل ملاحظه نیست؛ برعکس، این فرایند در آب های بسیار آلوده رخ می دهد. در تصفیه خانه های آب و فاضلاب، نیترات زدایی به عنوان یک روش کارآمد برای حذف نیتروژن فاضلاب ها مورد استفاده قرار می گیرد.
عملکرد مرحله نیتروژن زدایی را می توان با واکنش نوعی زیر نشان داد:

که در این واکنش، متانول (CH3OH)، به عنوان منبع کربن، الکترون دهنده است. البته ممکن است گونه های کربن آلی دیگری نیز به عنوان الکترون دهنده به مصرف باکتری ها برسند. در واکنش بالا ملاحظه می شود که به ازای هر مول کاهش نیترات، یک مول هیدروکسید (آنیون هیدروکسل) تولید و باعث افزایش قلیائیت می شود.
در سری فرایندهای نیترات سازی – نیترات زدایی، کاهش قلیائیت ناشی از نیترات سازی، به طور کامل توسط نیترات زدایی جبران نمی شوند؛ زیرا، به ازای هر مول آمونیاک که به طور هوازی به نیترات اکسیده شود، دو مول قلیائیت خنثی می گردد. در صورتی که به ازای هر مول نیترات که کاهیده شود، یک مول قلیائیت اضافه می شود.
بعضی از باکتری ها قادرند در شرایط بی هوازی باعث اکسایش آمونیوم شوند. این فرایندمیکروبی، به فرایند آناموکس (اکسایش آمونیوم به طریق هوازی) موسوم است. در این فرایند، نیتریت به عنوان الکترون پذیر عمل می کند و نهایتاً هر دو آمونیوم و نیتریت به گاز نیتروژن (N2) تبدیل می شوند. عملکرد فرایند آناموکس را می توان با واکنش زیر نشان داد:

فرایند آناموکس سهم عمده ای (حتی تا 50 درصد) در فرایند نیتروژن زدایی اقیانوس ها دارد و باعث می شود که نیتروژن، عامل محدود کنندۀ تولید اولیه و رشد گیاهان آبزی در آنها باشد.
نظرات بسته شده است.










